На 5 юли Novo Nordisk стартира клинично изпитване фаза III на инжекцията CagriSema в Китай, чиято цел е да сравни безопасността и ефикасността на инжекцията CagriSema със семеглутид при пациенти със затлъстяване и наднормено тегло в Китай.
Инжектирането на CagriSema е дългодействаща комбинирана терапия, разработвана от Novo Nordisk, основните компоненти са GLP-1 (глюкагон-подобен пептид-1) рецепторен агонист смеглутид и дългодействащ аналог на амилин кагрилинтид.CagriSema инжекция може да се прилага подкожно веднъж седмично.
Основната цел е да се сравни CagriSema (2,4 mg/2,4 mg) със семеглутид или плацебо веднъж седмично подкожно.Novo Nordisk обяви резултатите от изпитване на CagriSema за лечение на диабет стадий 2, което доказа, че хипогликемичният ефект на CagriSema е по-добър от този на семеглутид и почти 90% от пациентите са постигнали целта за HbA1c.
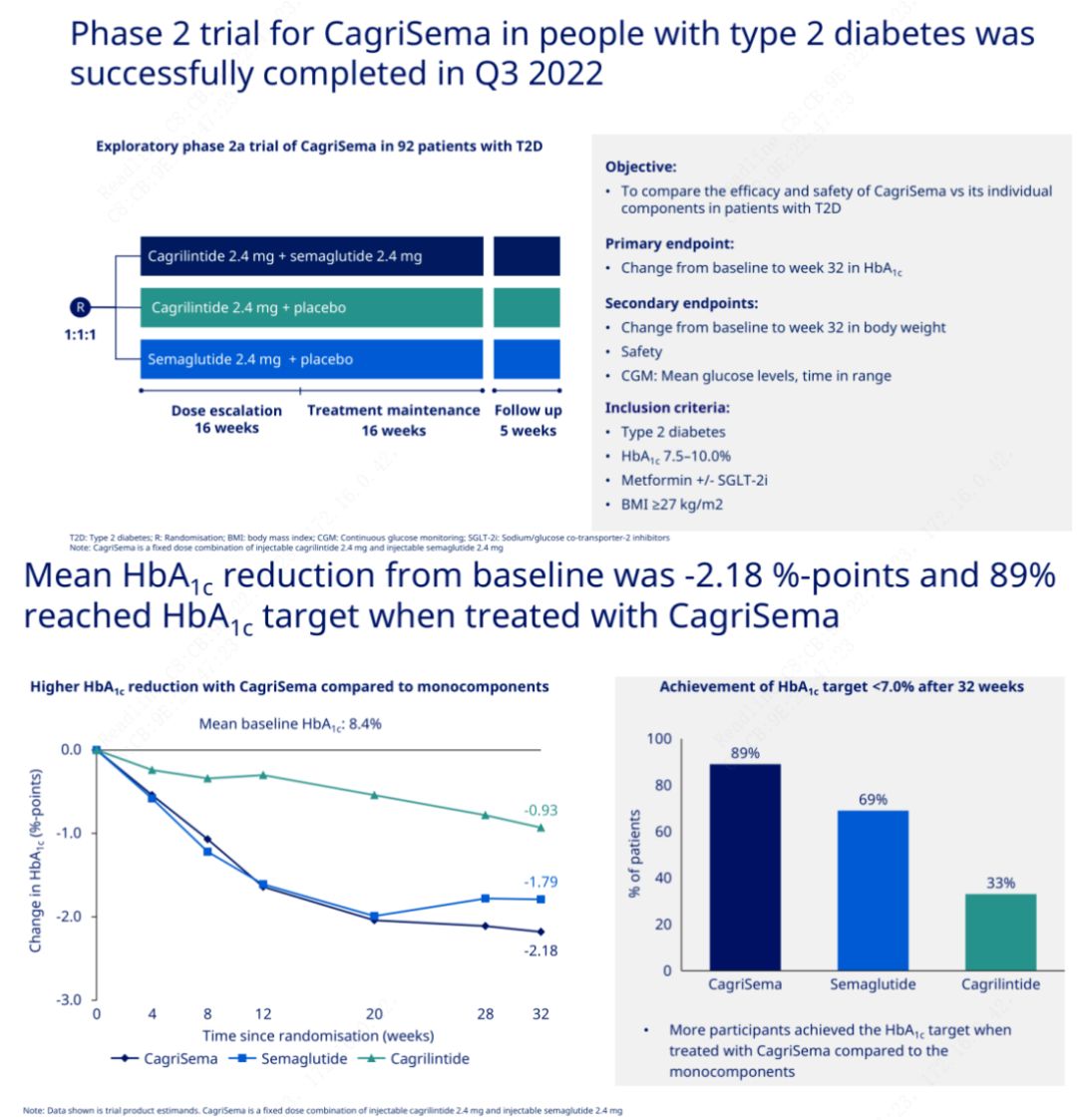
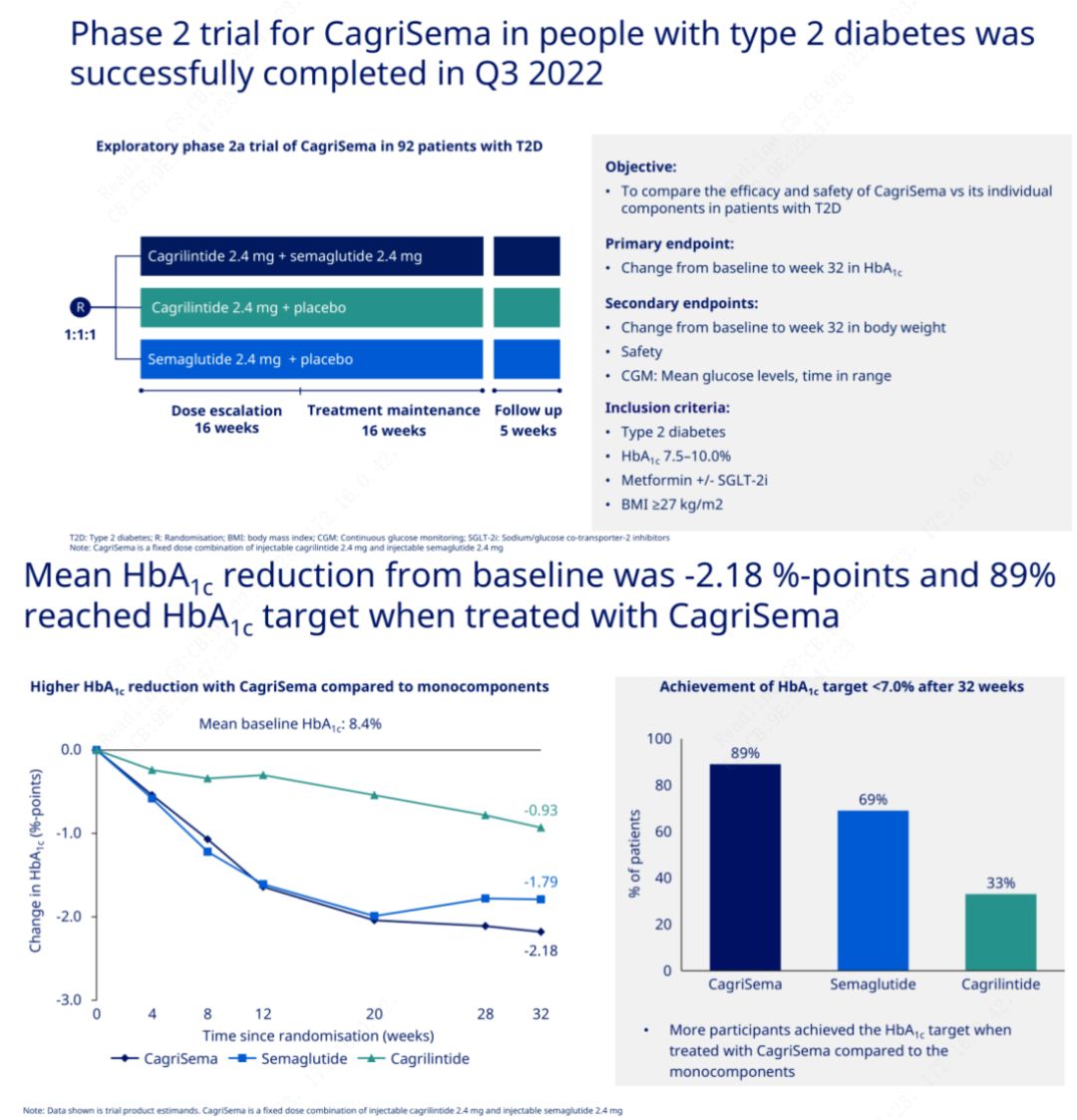
Данните показват, че в допълнение към значителния хипогликемичен ефект, по отношение на загубата на тегло, инжекцията CagriSema значително превъзхожда семеглутид (5,1%) и кагрилинтид (8,1%) със загуба на тегло от 15,6%.
Иновативното лекарство Tirzepatide е първият в света одобрен седмичен GIP/GLP-1 рецепторен агонист.Той съчетава ефектите на два инкретина в една молекула, която се инжектира веднъж седмично и е нов клас лечения за диабет тип 2.Тирзепатид беше одобрен от Американската администрация по храните и лекарствата (FDA) през май 2022 г. за подобряване на гликемичния контрол (на диетична основа и упражнения) при възрастни с диабет тип 2 и в момента е одобрен в Европейския съюз, Япония и други страни.
На 5 юли Eli Lilly обяви фаза III проучване SURPASS-CN-MONO относно регистрацията на клинични изпитвания на лекарства и платформата за разкриване на информация за лечение на пациенти с диабет тип 2.SURPASS-CN-MONO е рандомизирано, двойно-сляпо, плацебо-контролирано проучване фаза III, предназначено да оцени ефикасността и безопасността на монотерапията с тирзепатид в сравнение с плацебо при хора с диабет тип 2.Проучването планира да включи 200 пациенти с диабет тип 2, които не са приемали антидиабетни лекарства през 90-те дни преди посещение 1 (с изключение на определени клинични ситуации, като остро заболяване, хоспитализация или планова хирургия, краткосрочно (≤14 дни) употреба на инсулин).
Очаква се диабет тип 2 да бъде одобрен тази година
Миналия месец резултатите от проучване SURPASS-AP-Combo бяха публикувани на 25 май в хитовото списание Nature Medicine.Резултатите показват, че в сравнение с инсулин гларжин, Tirzepatide показва по-добър HbA1c и намаляване на теглото в популацията от пациенти с диабет тип 2 в Азиатско-тихоокеанския регион (главно Китай): намаление на HbA1c с до 2,49% и намаляване на теглото с до 7,2 kg (9,4%) на 40-та седмица от лечението, значително подобрение на кръвните липиди и кръвното налягане и общата безопасност и поносимост са добри.
Клиничното изпитване фаза 3 на SURPASS-AP-Combo е първото проучване на Tirzepatide, проведено главно при китайски пациенти с диабет тип 2, ръководено от професор Джи Линонг от Народната болница на Пекинския университет.SURPASS-AP-Combo е в съответствие с резултатите от глобалната серия от изследвания SURPASS, което допълнително доказва, че патофизиологията на диабета при китайски пациенти е в съответствие с тази на глобалните пациенти, което е основата за едновременното изследване и разработване на нови лекарства в Китай и света, а също така предоставя солидна подкрепа на доказателства за предоставяне на възможност на китайските пациенти да използват най-новите лекарства за лечение на диабет и тяхното клинично приложение в Китай възможно най-скоро.
Време на публикуване: 18 септември 2023 г

